La Farmacologia low dose nella terapia iniettiva (locale) e sistemica (orale)
per il trattamento dell’osteoartrosi
INTRODUZIONE
Le malattie muscolo-scheletriche (Mms) possono avere importanti ripercussioni sulla vita sociale dell’individuo (1) e condurre, con tempistiche e modalità differenti tra loro, ad una condizione di disabilità o all’inabilità al lavoro. Uno stile di vita inadeguato – in particolare obesità e ridotta attività fisica – così come il sovraccarico bio-meccanico e i movimenti ripetuti, o l’avanzare dell’età contribuiscono ad aumentare la prevalenza di molte di queste patologie; pertanto, nei prossimi anni, a causa del graduale invecchiamento della popolazione e della diffusione di abitudini progressivamente più sedentarie, si prevede un notevole incremento delle Mms.
Malattie quali mal di schiena, cervicalgie, artrosi, artrite, osteoporosi e altre Mms hanno già un peso considerevole sullo stato di salute della popolazione: si stima infatti che, in termini di impatto sulla salute globale, siano seconde solo alle patologie mentali e ai disturbi del comportamento.
Una diagnosi precoce (“La prima terapia è una buona diagnosi”) e un trattamento adeguato comporterebbero una riduzione della disabilità e un miglioramento della prognosi e dell’aspettativa di vita, con conseguente abbattimento anche dei costi indiretti: la disabilità e i costi economici e sociali di gestione delle Mms, infatti, sono direttamente proporzionali al loro stadio di progressione.
L’approccio alle Mms fino agli ultimi decenni è stato il riflesso dell’impostazione generale della Medicina, incardinata sulla visione riduzionistica dell’uomo e delle sue malattie.
Così è stato anche nell’interpretazione della fisio-patologia e nell’indagine dei percorsi etio-patogenetici della maggior parte delle malattie; e così anche nella ricerca e nello sviluppo dei farmaci, che raramente si sono discostati dalla direttrice one-drug-one-cell-one-target (un farmaco-una cellula-un bersaglio) e che quasi sempre sono stati pensati per agire su di un singolo bersaglio senza tenere conto delle sue molteplici connessioni ed interrelazioni, arrivando ad idealizzarli come una sorta di magic bullet.
VERSO NUOVI PARADIGMI
Ma queto approccio non è più sufficiente e non è più sostenibile.
Negli ultimi 30 anni, lo sviluppo esponenziale di nuove tecnologie scientifiche e mediche è giunto ad un punto in cui l’identificazione e la caratterizzazione di un elevato numero di fattori molecolari correlati alla patogenesi di una malattia non può più, se non con grande difficoltà, essere integrata e processata attraverso approcci analitici di tipo convenzionale.
Appare chiaro che occorra una nuova visione prospettica ed un cambiamento di approccio verso la complessità del mondo vivente. La Medicina dei Sistemi (2-6) appare perfettamente sovrapponibile a questa nuova necessità ed in grado di soddisfare le nuove esigenze emerse dai progressi nell’interpretazione dell’etiopatogenesi delle malattie, incuse quelle a carico dell’Apparato muscoloscheletrico. La visione sistemica delle affezioni dell’Apparato muscolo-scheletrico sta infatti sempre più affermandosi: si pensi alla connessione muscolo-cervello (mediate da BDNF – Brain Derived Neutrophic Factor, una neurotrofina fondamentale per la plasticità del cervello) che rappresentano un esempio di interazione virtuosa tra organi la cui connessione è generalmente trascurata, o alla connessione tra intestino-articolazioni (mediate dal microbiota intestinale) dove, con una accezione negativa, l’infiammazione locale intestinale ha un riverbero sistemico anche a livello articolare (figura 1).
Lo shift da visione riduzionistica a sistemica nello studio dell’asse muscolo-cervello ha messo in luce l’importanza dell’attività fisica nella protezione dalle patologie neurodegenerative, processo mediato dalle vie metaboliche che coinvolgono il BDNF. Il muscolo, durante l’attività fisica, produce più di 300 miochine e tra queste particolare importanza riveste l’Irisina, molecola in grado di indurre l’aumento dei livelli di BDNF nell’ippocampo favorendo la formazione di sinapsi e sostenendo la funzione neuronale; il sostegno dell’attività neuronale a livello ippocampale è fondamentale per ridurre il rischio di insorgenza di patologie neurodegenerative (7-10).
Allo stesso modo, lo studio dei riflessi sistemici dell’alterazione dell’omeostasi intestinale ha messo in evidenza come l’aumentata permeabilità intestinale (Leaky Gut Syndrome) (11) e/o la modificazione patologica della composizione del microbiota intestinale (ad esempio sovrappopolazione di batteri quali Clostridium, Streptococcus, Bacteroides e Firmicutes) (12) siano corresponsabili dell’innesco di stati infiammatori sistemici cronici di bassa intensità.
Questa condizione infiammatoria sistemica è responsabile, a livello articolare, dell’onset dell’infiammazione locale e della risposta autoimmune causata dal richiamo incontrollato di cellule del sistema immunitario, fattori che portano alla progressiva degenerazione morfo-funzionale dell’articolazione stessa.
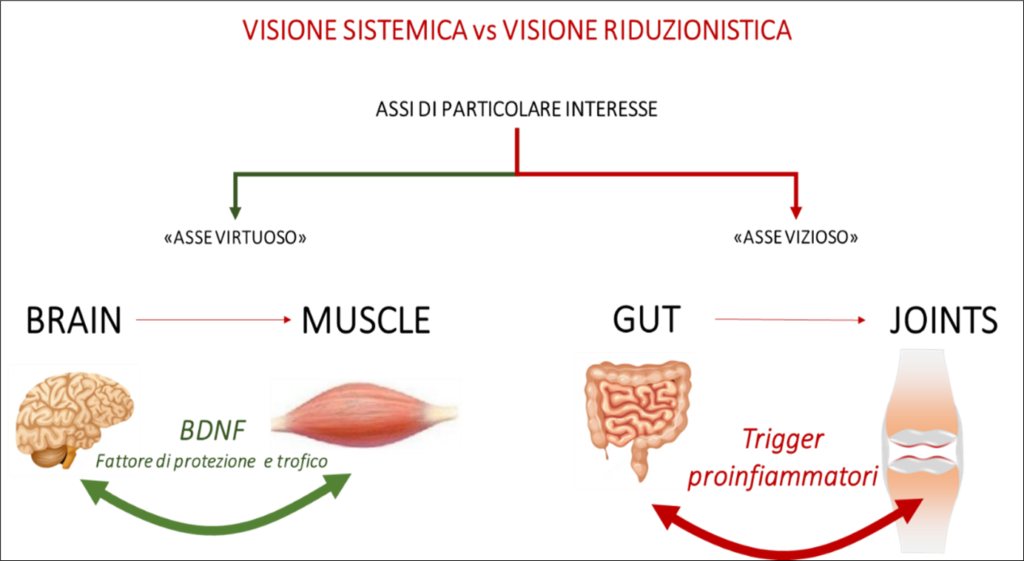
Figura 1 – lo shift da visione riduzionistica a sistemica ha consentito una più accurata comprensione dei concetti di “asse” tra organi e sistemi permettendo lo studio delle interazioni sia positive che negative che avvengono all’interno degli assi stessi.
Il concetto di spreading di mediatori dell’infiammazione in grado di provocare danni sistemici a partire da condizioni patologiche locali ha iniziato ad affermarsi già nel 2011 grazie ai lavori di Mcinnes e colleghi che descrissero nel loro articolo The pathogenesis of rheumatoid arthritis. (13)la bidirezionalità con cui viaggiano alcune citochine pro-infiammatorie (su tutte IL-6) nell’indurre processi infiammatori e degenerativi su tessuti o organi a distanza rispetto al focolaio primario, come nel caso citato di un’articolazione artrosica o artritica (Figura 2).
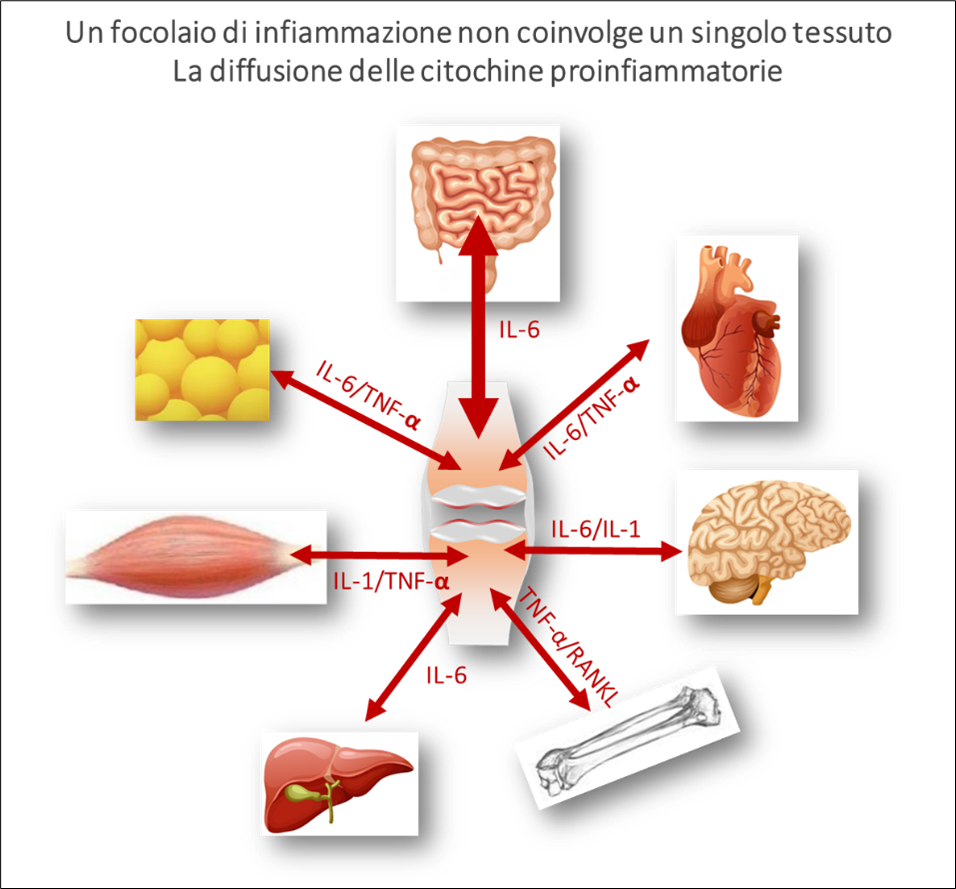
Figura 2 – spreading dei mediatori dell’infiammazione (modificata da Mcinnes IB. et al. The pathogenesis of rheumatoid arthritis. N Engl J Med. 2011)
Un’articolazione artrosica si configura così non più e solo come problema dello specialista ortopedico, reumatologo o fisiatra ma come problema “internistico”. La gestione razionale della patologia secondo questa visione condurrà non solo al miglioramento dei segni e sintomi della patologia articolare ma anche alla riduzione dei fattori di rischio per un ampio range di patologie (malattie cardiovascolari, neurodegenerative, osteoporosi, sarcopenia, eccetera).
OSTEOARTROSI: UNA PATOLOGIA LOCALE E SISTEMICA
Le patologie artrosiche hanno un altissimo impatto e colpiscono una larga fetta della popolazione soprattutto nei paesi industrializzati e ad alto tasso di sviluppo. Per quanto riguarda l’osteoartrosi, la prevalenza si attesta sul 9,6% degli uomini e il 18% delle donne con più di 60 anni.
Secondo l’indagine multiscopo realizzata annualmente dall’Istituto Nazionale di Statistica l’artrosi/artrite interessa il 16,4% della popolazione, risultando tra le malattie o condizioni croniche più diffuse in Italia (14). La prevalenza di questa patologia aumenta con l’età e presenta nette differenze di genere (tra gli over-75, il 68,2% delle donne e il 48,7% degli uomini dichiarano di soffrire di artrosi/artrite).
L’osteoartrosi è una patologia degenerativa progressiva nella quale il processo infiammatorio, principalmente a carico delle cartilagini articolari, gioca un ruolo chiave nell’alterazione dell’equilibrio omeostatico del turnover della Matrice Extra-Cellulare deposta dai condrociti che sta alla base della distruzione del tessuto cartilagineo
È ai condrociti, dunque, che deve mirare una corretta terapia farmacologica dell’artrosi, una terapia che consideri non solo la gestione del sintomo ma che consideri prima di tutto gli aspetti eziopatogenetici della patologia degenerativa osteoarticolare. L’osteoartrosi è anche una patologia sistemica, come dimostrato dalla numerosa letteratura che indica nell’alterata permeabilità intestinale e nella conseguente infiammazione sistemica che ne segue uno dei componenti etiologici principali della OA. Ne consegue che anche il trattamento farmacologico della OA debba essere duplice, sistemico e locale, volto alla gestione dell’infiammazione sia locale che sistemica ed al sostegno al trofismo dei condrociti, conditio sine qua non per la corretta deposizione di nuova ECM e altri costituenti della cartilagine; i meccanismi infiammatori legati ai meccanismi immunitari innati e alla risposta infiammatoria intrinseca dei condrociti e il decadimento delle loro funzioni metaboliche possono rappresentare degli importanti target terapeutici .
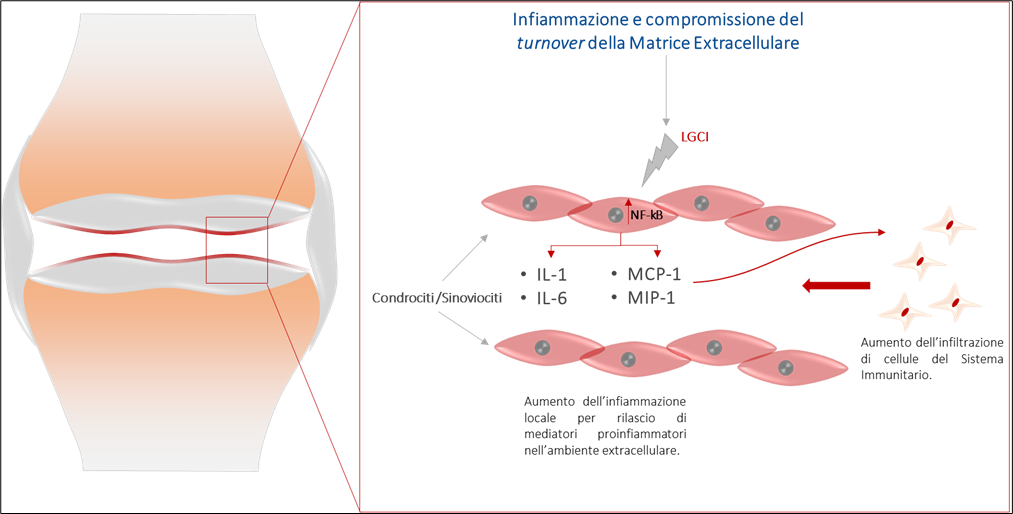
Figura 3 – Infiammazione e compromissione del turnover della Matrice Extracellulare. L’infiammazione sistemica di basso grado innesca una risposta infiammatoria ed immunitaria locale con alterazione del metabolismo dei condrociti e dei sinoviociti ed elevato richiamo di cellule del Sistema Immunitario.
OSTEOARTROSI: NUOVE OPPORTUNITÀ DI TRATTAMENTO NATURALE LOW DOSE
La terapia farmacologica tradizionale dell’artrosi prevede generalmente la somministrazione di antinfiammatori steroidei e non-steroidei (in associazione o meno a condroprotettori). Così impostata, tuttavia, essa non risponde alla necessità sopraesposta di intervenire in modo mirato a livello locale e sistemico, possibilità invece offerta dalla Medicina dei Sistemi. In particolare, è possibile, attraverso medicinali naturali low dose multicomponent/multitarget somministrabili per via iniettiva gestire localmente la degenerazione tissutale alla base della progressiva compromissione morfo-funzionale dell’articolazione; contestualmente, attraverso l’utilizzo di medicinali biologici low dose per uso orale, gestire a livello sistemico il principale fattore etiologico dell’osteoartrosi, ossia l’infiammazione cronica che, come un fuoco inestinguibile, compromette dalle fondamenta l’edifico articolare inibendo tutti i meccanismi di risoluzione dell’infiammazione stessa e di ricostruzione del tessuto. Viene pertanto a configurarsi una strategia terapeutica articolata in due momenti:
- Terapia iniettiva locale
- Terapia orale sistemica
- Terapia iniettiva locale dell’Osteoartrosi
A livello locale, la terapia iniettiva con il medicinale naturale a basso dosaggio multicomponent/multitarget Zeel® T (Heel GmbH, Baden-Baden – Germany) si è dimostrata efficace, convalidata sia da studi preclinici che clinici.
Di particolare interesse l’analisi della composizione di Zeel® T.
Il suo rationale d’azione è inscritto nella sua essenza di medicinale multicomponent-multitarget. Infatti, nella sua struttura è possibile identificare 3 nuclei d’azione che vanno precisamente a sovrapporsi ai diversi step patogenetici della malattia artrosica, sequenzialmente concatenati tra loro:
Insulto traumatico e/o invecchiamento e/o processo infiammatorio cronico
↓
Danno enzimatico
↓
Rallentamento dei metabolismi cellulari
↓
Degenerazione cellulare
↓
Destrutturazione tissutale
È su questa “cascata” di eventi patogenetici che agisce Zeel® T, attraverso l’azione coordinata dei suoi tre nuclei di componenti.
- Catalizzatori intermedi (Nad D8-Coenzym A D8; Ac. α-lipoicum D8; Natrium oxalaceticum D8)
- Organoterapici “Suis” (Cartilago suis D6; Funiculus umbilicalis suis D6; Embryo tot. suis D6; Placenta suis D6)
- Derivati vegetali e minerali (Arnica montana D4; Rhus toxicodendron D2; Solanum dulcamara D3; Symphytum officinale D6; Sanguinaria canadensis D4-Sulfur D6).
Ciascuno dei tre nuclei del farmaco sviluppa, attraverso i propri componenti, un tropismo strutturale e funzionale specifico per ognuno dei momenti evolutivi della cascata eziopatogenetica dell’artrosi:
- Nucleo dei Catalizzatori intermedi
ha come bersaglio elettivo il mitocondrio su cui agisce con un’azione di sblocco sui meccanismi deputati al metabolismo energetico (bilanciamento tra metabolismo aerobico ed anaerobico) attraverso la stimolazione enzimatica indotta dalle diluizioni omeopatiche.
- Nucleo degli Organoterapici Suis
Al suo interno è interessante notare la presenza di Funiculus Umbilicalis, ricco di glicosamminoglicani,
Cartilago suis che esercita un effetto di stimolo sul metabolismo cartilagineo attraverso la riattivazione dei sistemi enzimatici che presiedono alla sintesi dei mucopolisaccaridi, in particolare della condroitina-solfato idrofila, fondamentale per l’integrità della cartilagine, Placenta ed Embryo tot. suis che lavorano sulla vascolarizzazione del tessuto sub-condrale.
- Derivati vegetali e minerali
Il processo infiammatorio cronico, oltre che essere causa, talvolta scatenante, della destrutturazione cartilaginea, è sempre causa fondamentale per la progressiva perdita di robustezza della Sostanza Fondamentale (lo stato ossidativo indotto dall’infiammazione rompe i ponti disolfuro dei mucopolisaccaridi solforati e dell’ac. ialuronico). La presenza in questo nucleo di estratti vegetali e di minerali a basso dosaggio come Rhus Toxicodendron D2 (dolori reumatici che peggiorano la notte, con l’immobilità o all’inizio del movimento, e sono, viceversa, migliorati dal movimento (classica sintomatologia dell’artrosi), Arnica montana D4 (dolori di tipo contusivo), Solanum dulcamara D3 (dolori che peggiorano con il tempo freddo-umido), Sanguinaria canadensis D4 (dolori nevralgici, contusivi; particolare tropismo per anca e spalla), Sulfur (rimedio di riattivazione tissutale), Ac. Silicicum (affezioni dei tessuti molli), Symphytum officinale (affezioni ossee e osteoalgie)
La presenza di questi componenti permette di giustificare l’azione anche antinfiammatoria di Zeel T, che sin estrinseca nella modulazione dello stato di flogosi locale e nella gestione della sintomatologia algica articolare attraverso il controllo di COX-LOX mediati (Inflammation Research 2004)
Evidenze Dalla Ricerca
Studi osservazionali hanno, nel corso di anni di pratica clinica, messo in luce come Zeel® T si dimostri efficace per via iniettiva intra- e periarticolare nel trattamento della gonartrosi (15-17). La sensibilità soggettiva al dolore durante il movimento attivo dell’articolazione artrosica, la mobilità dell’articolazione stessa e la valutazione generale della tollerabilità da parte dei pazienti sono i parametri fondamentali utilizzati per valutare l’efficacia della terapia iniettiva con Zeel® T; tutti le osservazioni riportate negli studi sono concordi nell’attribuire a Zeel® T significative capacità di controllo del dolore e di miglioramento della mobilità articolare, effetti entrambi legati ad un miglioramento delle caratteristiche morfo-funzionali dell’articolazione.
Queste evidenze cliniche sono state confermate dall’analisi dei meccanismi fisiopatologici coinvolti nei fenomeni artrosici. Attraverso le moderne tecniche di analisi genomica e proteomica (18) si è potuto dimostrare come il medicinale multicomponent/multitarget Zeel® T sia in grado di influenzare positivamente il metabolismo cellulare di condrociti primari prelevati da soggetti affetti da OA promuovendo la condrogenesi caratterizzata primariamente dalla stimolazione della sintesi di collagene di Tipo II, fondamentale per il mantenimento di buone caratteristiche meccaniche delle cartilagine e di conseguenza, di una sua buona funzionalità. Questi risultati evidenziano come la natura multicomponent/multitarget di Zeel® T sia fondamentale per gestire in modo coordinato l’infiammazione e i processi di sintesi della matrice.
I risultati ottenuti consentoNO di ipotizzare l’utilizzo di Zeel® T nel trattamento iniettivo dell’osteoartrosi allo scopo di mantenere alto l’anabolismo del condrocita, condizione indispensabile per il mantenimento delle migliori condizioni morfo-funzionali della cartilagine articolare.
Zeel® T si dimostra in grado di modulare l’espressione di numero geni coinvolti nel metabolismo cellulare del condrocita. In particolare, un gene riveste un ruolo particolarmente significativo: CCN1 (CCN family member 1) la cui modulazione è centrale per il buon funzionamento del condrocita (Figura 4).
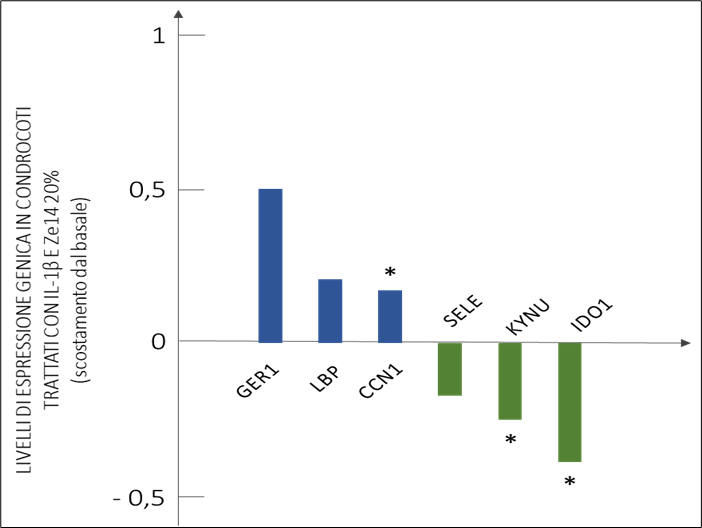
Figura 4 – Modificazione dell’espressione genica in condrociti primari da pazienti affetti da OA trattati con Zeel® T. Si noti l’incremento di espressione di CCN1.
La regolazione dell’espressione di CCN1 è un meccanismo fondamentale per il controllo del turnover della matrice, controllando i cicli dell’aggrecano e del Collagene di Tipo II (Figura 5), componenti fondamentali dell’ECM della cartilagine. La sua up-regolazione ad opera di Zeel® T favorisce una maggiore sintesi (ad andamento linearmente correlato) sia dell’Aggrecano che del Collagene di Tipo II da parte del condrocita.
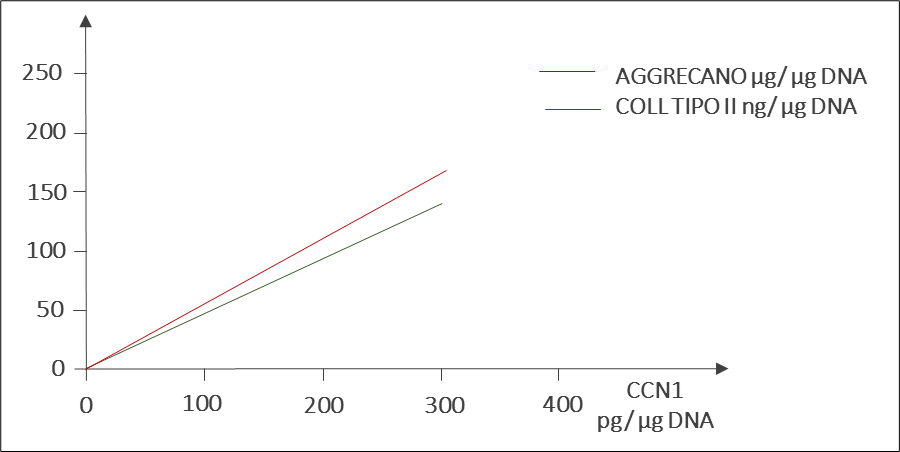
Figura 5 – Induzione lineare dell’espressione di aggrecano e collagene di Tipo II da parte di CCN1
Zeel® T agisce anche sull’espressione di metalloproteinasi. In particolare, il composto si dimostra in grado di ridurre l’espressione di MMP-13 (Figura 6), enzima coinvolto nella degradazione della matrice e legato allo stato di ipertrofia tipico del condrocita in presenza di OA.
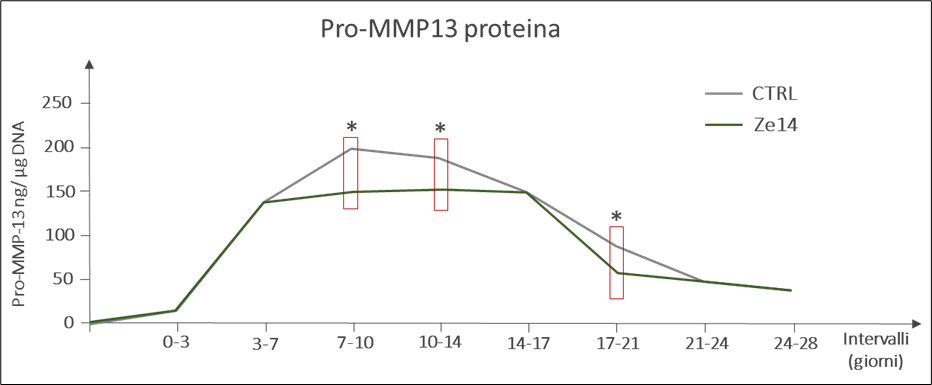
Figura 6 – Andamento dei livelli di pro-MMP-13 in condrociti controllo e trattati con Zeel® T (* p < 0.05)
Nel loro complesso i dati di genomica e metabolomica dimostrano come il medicinale multicomponent/multitarget Zeel® T sia in grado di influenzare positivamente il metabolismo cellulare dei condrociti primari prelevati da soggetti affetti da OA promuovendo la condrogenesi caratterizzata primariamente dalla stimolazione della sintesi di collagene di Tipo II, fondamentale per il mantenimento di buone caratteristiche meccaniche della cartilagine e di conseguenza, di una sua buona funzionalità. I risultati preclinici e clinici ottenuti con Zeel® T ne sottolineano l’efficacia nel trattamento iniettivo dell’osteoartrosi allo scopo di mantenere alto l’anabolismo del condrocita, condizione indispensabile per il mantenimento delle migliori condizioni morfo-funzionali della cartilagine articolare.
- Terapia orale sistemica dell’Osteoartrosi
Parallelamente, l’utilizzo dei medicinali biologici low dose GUNA-ANTI IL-1 GUNA-INTERLEUKIN 10 (GUNA S.p.a Milano – Italia) ha dimostrato la loro capacità di modulare l’espressione genica e proteica di alcune tra le principali citochine proinfiammatorie e fattori chemiotattici legati all’onset ed alla progressione dello stato infiammatorio cronico legato alla OA.
Evidenze Dalla Ricerca
GUNA-ANTI IL-1 GUNA-INTERLEUKIN 10 (19) sono in grado di ridurre l’espressione citochine proinfiammatorie (Figura 7), di bloccare i meccanismi intracellulari di induzione della risposta infiammatoria mediante il blocco della traslocazione nucleare di NF-kB e (Figura 8) e di ridurre il rilascio di mediatori chemotattici per il richiamo delle cellule del sistema immunitario (Figura 9).
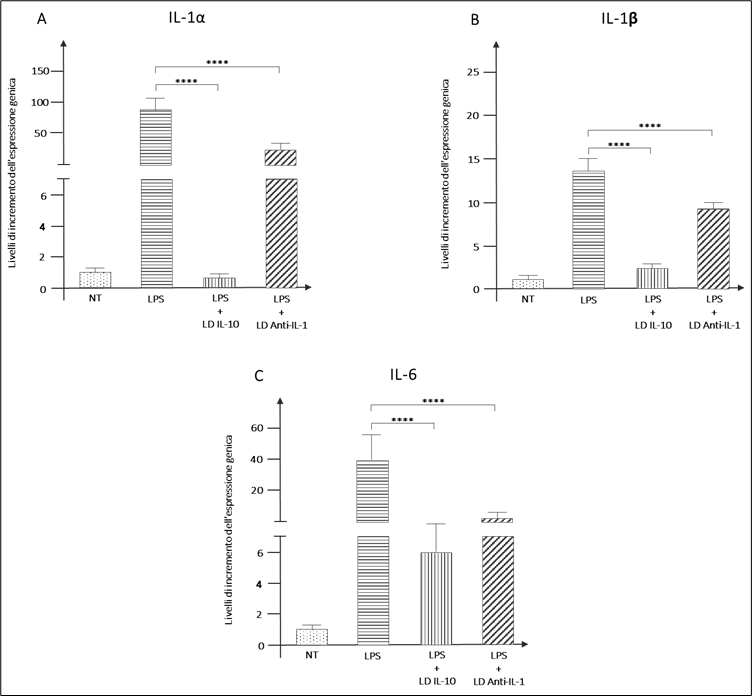
Figura 7 – GUNA-ANTI IL-1 GUNA-INTERLEUKIN 10 riducono l’espressione genica di IL-1α (A), IL-1β (B) e IL-6 (C), principali citochine trigger dell’infiammazione a livello articolare (****p<0.0001)
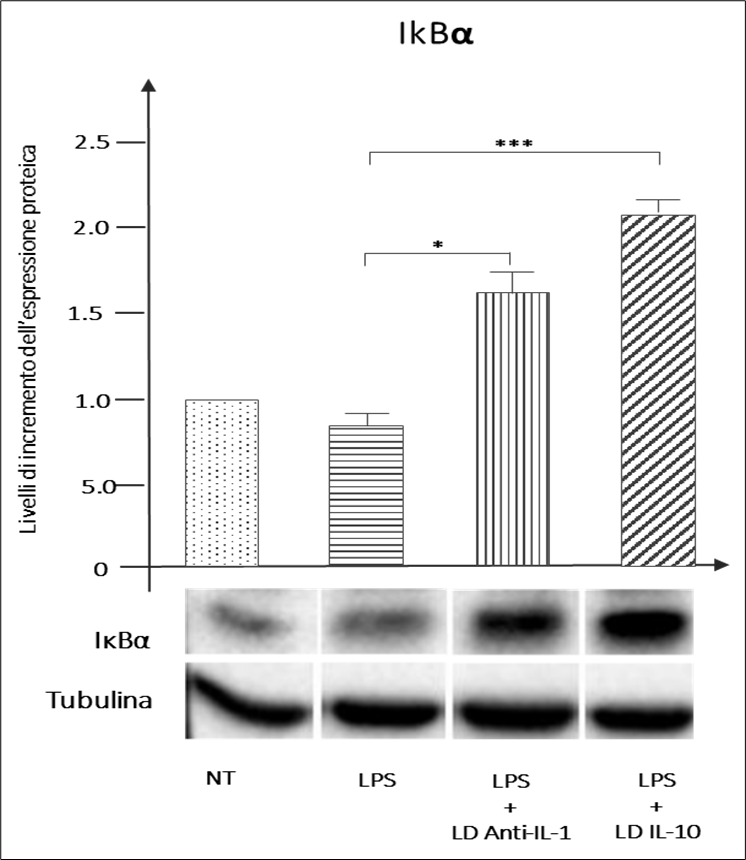
Figura 8 – incremento dell’espressione di IκBα da parte di GUNA-ANTI IL-1 GUNA-INTERLEUKIN 10. IκBα elevato è associato ad una minore traslocazione nucleare di NF-kB in presenza di stressor infiammatori. (***p<0,001, *p<0,05)
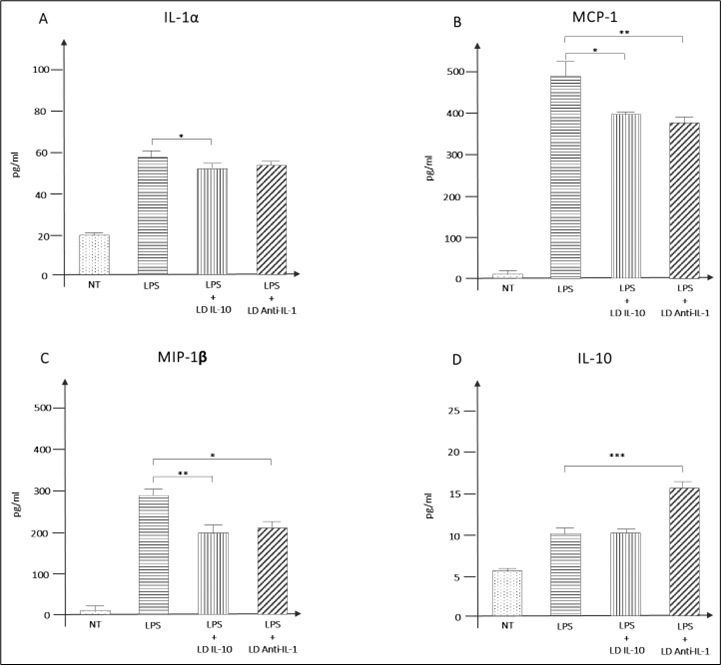
Figura 9 – GUNA-ANTI IL-1 GUNA-INTERLEUKIN 10 riducono la sintesi e la liberazione nell’ambiente extracellulare di IL-1α (A), MCP-1 (B) e MIP-1β (C) mentre incrementano quella di IL-10 (D). Nel complesso, questo assetto citochinico descrive una azione anti-infiammatoria ( ***p<0.001, **p<0,01, *p<0,05).
Questi aspetti sono tutti cruciali nei meccanismi di onset e progressione della OA. Non solo la down-regolazione delle vie di segnale proinfiammatorio è fondamentale, ma anche l’incremento del rilascio nell’ambiente extracellulare di IL-10 enfatizza l’azione antinfiammatoria di GUNA-ANTI IL-1 e GUNA-INTERLEUKIN 10.
In sintesi, GUNA-ANTI IL-1 GUNA-INTERLEUKIN 10 sono in grado di interferire con i meccanismi della LGCI non solo dal punto di vista dell’espressione dei suoi principali marker molecolari ma anche dal punto di vista del coinvolgimento della componente cellulare della risposta immune, evidenziando la capacità di inibire il richiamo di cellule immunitarie nel sito di infiammazione.
I risultati ottenuti sostengono l’utilizzo di GUNA-ANTI IL-1 e GUNA-INTERLEUKIN 10 nel trattamento orale dell’osteoartrosi allo scopo di mantenere sotto controllo la risposta immune, sia in termini di rilascio di mediatori citochinici proinfiammatori sia di richiamo di cellule del Sistema Immunitario nel sito d’infiammazione, condizione indispensabile per il mantenimento delle migliori condizioni morfo-funzionali della cartilagine articolare.
CONCLUSIONI
L’analisi delle esperienze cliniche e precliniche con Zeel® T, GUNA-ANTI IL-1 e GUNA-INTERLEUKIN 10 evidenzia il potenziale terapeutico dell’approccio low dose per il trattamento locale e sistemico dell’osteoartrosi.
In sintesi, Zeel® T è in grado di influenzare positivamente il metabolismo cellulare dei condrociti promuovendo la condrogenesi ed il turnover dell’ECM, processo fondamentale per il mantenimento di buone caratteristiche morfo-funzionali della cartilagine. GUNA-ANTI IL-1 e GUNA-INTERLEUKIN 10 regolano in maniera raffinata la risposta infiammatoria sistemica e locale, down-regolando la risposta immunitaria locale, anche di natura autoimmune.
Zeel® T, GUNA-ANTI IL-1 e GUNA-INTERLEUKIN 10 agiscono dunque in modo complementare e sinergico sui meccanismi di onset e progressione della degenerazione articolare ed il loro utilizzo (Figura 10) rappresenta una completa terapia farmacologica combinata per il trattamento dell’osteoartrosi, la cui efficacia si associa, inoltre, da alte compliance e safety, caratteristiche distintive degli approcci terapeutici con medicinali low dose.
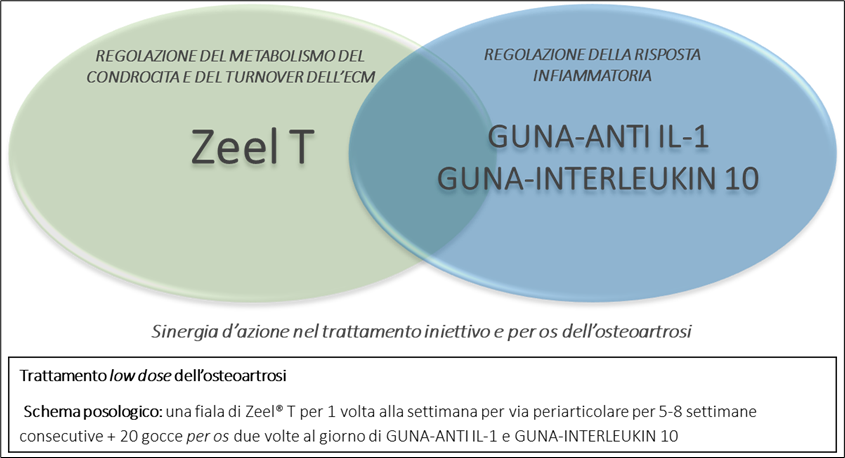
Figura 10 – visual abstract del concetto di sinergia d’azione tra Zeel® T, GUNA-ANTI IL-1 e GUNA-INTERLEUKIN 10 e proposta di schema posologico per il trattamento complementare dell’osteoartrosi.
Corresponding Author:
Alessandro Perra – a.perra@guna.it
Referenze bibliografiche
- Beaudart C, Biver E, Bruyère O, Cooper C, Al-Daghri N, Reginster JY, Rizzoli R. Quality of life assessment in musculo-skeletal health. Aging Clin Exp Res. 2018;30(5):413-418.
- Ahn AC, Tewari M, Poon CS, Phillips RS. The clinical applications of a systems approach. PLoS Med. 2006;3(7):e209.
- Barabasi AL, Albert R. Emergence of scaling in random networks. Science. 1999;286(5439):509–512.
- Barabási AL, Gulbahce N, Loscalzo J. Network medicine: a network-based approach to human disease. Nat Rev Genet. 2011;12(1):56-68.
- Barbour JA, Turner N. Mitochondrial stress signaling promotes cellular adaptations. Int J Cell Biol. 2014;2014:156020.
- Bland JS, Minich DM, Eck BM. A Systems Medicine approach: translating emerging science into individualized wellness. Adv Med. 2017;2017:1718957.
- Pedersen BK. Physical activity and muscle-brain crosstalk. Nat Rev Endocrinol. 2019;15(7):383-392.
- Jang C, Obeyesekere VR, Dilley RJ, Alford FP, Inder WJ. 11Beta hydroxysteroid dehydrogenase type 1 is expressed and is biologically active in human skeletal muscle. Clin Endocrinol (Oxf). 2006;65(6):800-805.
- Clow C, Jasmin BJ. Brain-derived neurotrophic factor regulates satellite cell differentiation and skeletal muscle regeneration. Mol Biol Cell. 2010;21(13):2182-2190.
- Miura P, Amirouche A, Clow C, Bélanger G, Jasmin BJ. Brain-derived neurotrophic factor expression is repressed during myogenic differentiation by miR-206. J Neurochem. 2012;120(2):230-238.
- Camilleri M. Leaky gut: mechanisms, measurement and clinical implications in humans. Gut. 2019;68(8):1516-1526.
- Bonato A, Zenobi-Wong M, Barreto G, Huang Z. A systematic review of microbiome composition in osteoarthritis subjects. Osteoarthritis Cartilage. 2022;30(6):786-801.
- McInnes IB, Schett G. The pathogenesis of rheumatoid arthritis. N Engl J Med. 2011;365(23):2205-19.
- https://www.epicentro.iss.it/muscolo-scheletriche/epidemiologia-italia
- Weiser-Metelman. Terapia della gonartrosi con Zeel T®: risultati di uno studio multicentrico. La Med Biol. 1995;4:2-10.
- Potrafki B. Somministrazione di Zeel T® per via periarticolare nei casi di gonartrosi: l’alternativa all’iniezione intra-articolare. La Med Biol. 1997;1:13-4.
- Nahler G, Metelmann H, Sperber H. Terapia della gonartrosi con Zeel vs Acido jaluronico. La Med Biol. 1997;2:11-6.
- Sanchez C, Hemmer K, Krömmelbein N, Seilheimer B, Dubuc JE, Antoine C, Henrotin Y. Reduction of Matrix Metallopeptidase 13 and Promotion of Chondrogenesis by Zeel T in Primary Human Osteoarthritic ChondrocytesFront Pharmacol. 2021;12:635034.
- Iuliano M, Santilli V, Mineo A, Paoloni M, Rosa P, Mangino G, Romeo G. Inflammatory Response Modulation by Low-Dose Anti-inflammatory Drugs Treatment in an in vitro Osteoarthritis Cellular Model. Curr Med Chem. 2023. Epub ahead of print.